티스토리 뷰
지방과 근육, 세포의 경계를 넘다 (3)
버려지던 세포가 산업의 중심으로
예전에는 다이어트 수술이나 성형 시술 후 버려지던 지방 조직이,
이제는 치료 산업의 핵심 원료로 주목받고 있는데요.
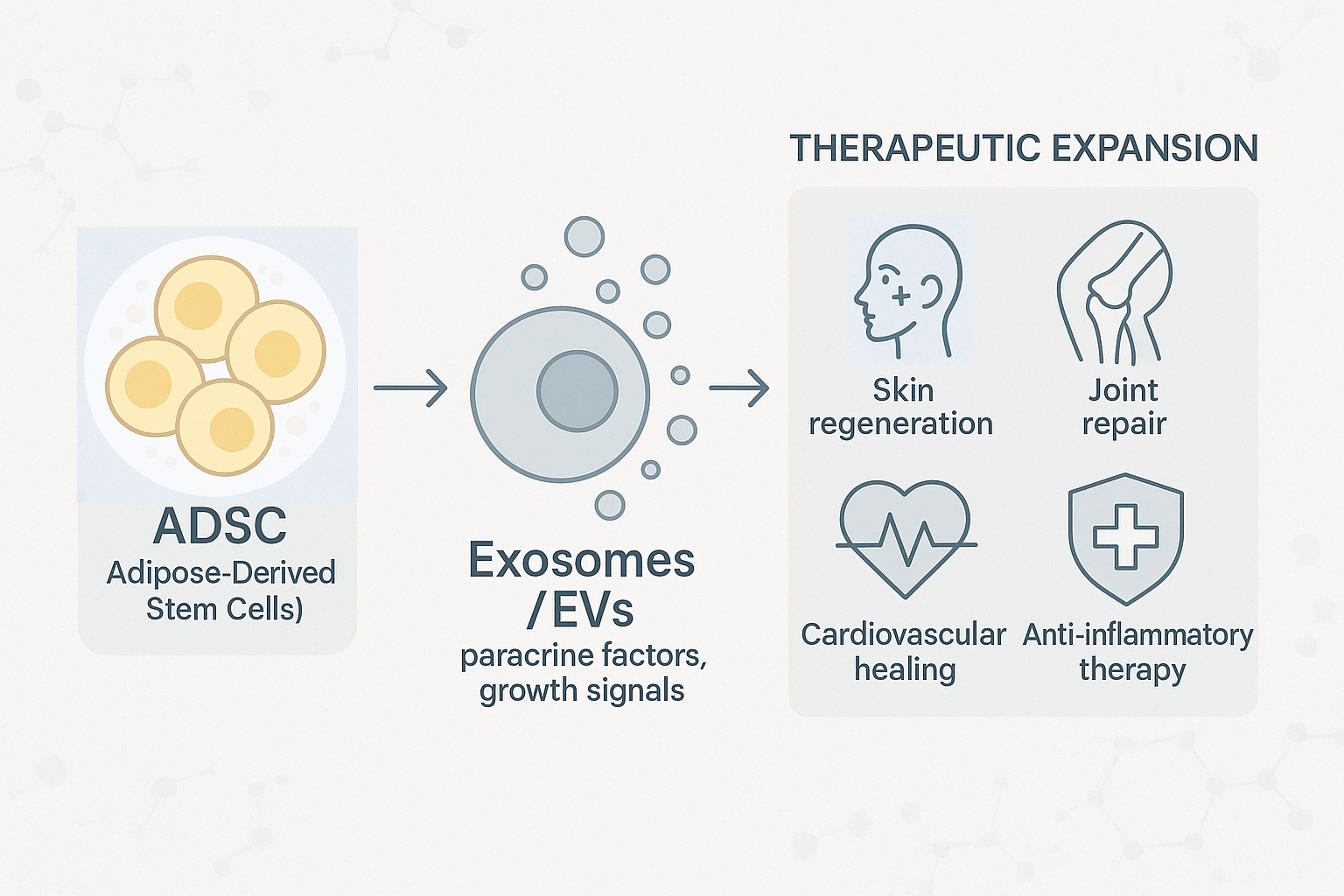
지방 유래 줄기세포(ADSC, Adipose-Derived Stem Cells)는 채취가 쉽고 증식력이 높으며,
세포 치료와 재생의학의 새로운 가능성을 열고 있습니다.
현재 산업의 관심은 “시술용 세포”에서 “의약품형 세포치료제” 로 빠르게 이동하고 있으며,
응용 범위도 미용과 재건뿐만 아니라 만성 상처, 염증성 질환, 관절·혈관 재생 등으로 확장되고 있습니다.
1. 시장 현황과 성장 전망
최근 글로벌 바이오 시장에서 지방 유래 줄기세포(ADSC, Adipose-Derived Stem Cell)
산업은 재생의학의 축으로 빠르게 자리 잡고 있습니다.
줄기세포 치료제 전체 시장 역시 꾸준히 확대되고 있습니다.
Grand View Research (2025) 보고서에 따르면,
전 세계 줄기세포 치료제 시장은 2024년 4억 5600만 달러(약 6500억 원)에서
2030년 16억 7000만 달러(약 2.36조 원)로 성장할 것으로 예측됩니다.
이 중 지방 유래 줄기세포는 가장 상용화 가능성이 높은 세포 자원으로 평가됩니다.
글로벌 재생의학 & 줄기세포 치료 시장 요약
※ 수치는 최근 공개 자료에 기반한 추정치입니다. (환산: $1 ≈ ₩1,350)
| 구분 | 2024년 | 2030/2034년 | CAGR | 성장 동인 |
|---|---|---|---|---|
| 재생의학 시장 (전체) | $34.2B (≈ ₩46조) | $125.6B (≈ ₩169조, 2034) | ~13.9% | 고령화, 기술혁신, 정부 지원·규제 가이드라인 구체화 |
| 줄기세포 치료제 시장 (전체) | $0.456B (≈ ₩6,500억) | $1.67B (≈ ₩2.25조, 2030) | ~11% 내외 | 임상 확대, 투자 증가, 조건부 허가 등 |
| ADSC 세그먼트 | (상위시장 내 핵심 세그먼트) | 두 자릿수 성장 전망 | ~10–15% 추정 | 채취 용이성, 대량 생산성, 미용→치료 확장, 표준화 진전 |
이러한 성장의 배경에는
① 고령화와 함께 증가하는 대사성 질환(당뇨, 관절염, 심혈관 질환),
② 각국 정부의 재생의료 규제 완화,
③ 그리고 세포 치료의 임상 성공 사례 증가가 있습니다.
특히 한국과 일본은 ‘조건부 허가(conditional approval)’ 제도를 통해
임상 2상 수준에서도 상용화를 허용하며 빠른 시장 진입 모델을 구축했습니다.
반면 미국과 유럽(EU) 은 FDA와 EMA가 세포치료 가이드라인을 구체화하고,
벤처 투자와 제약사 협력을 통해 ADSC 응용 분야의 표준화와 안전성 검증을 강화하고 있습니다.
결국, 지방 줄기세포 시장의 성장은 단순한 미용·시술 중심에서 벗어나
의약품형 세포치료제와 맞춤형 재생의학으로 중심축이 이동하는 과정이라 할 수 있습니다.
2. 규제와 임상 환경
지방 유래 줄기세포(ADSC) 치료제는 전 세계적으로 재생의학 상용화의 시험대가 되어왔습니다.
한국은 이 분야에서 가장 앞서간 국가 중 하나입니다.
2012년, 식품의약품안전처(MFDS)는 ㈜안트로젠(Antrogen)의
Cupistem®(자가 지방유래 줄기세포를 이용한 크론병 누공 치료제)을 세계 최초로 허가했습니다.
이는 “지방에서 얻은 세포로 질환을 치료할 수 있다”는 개념을 규제기관이 처음으로 공식 인정한 사례로,
이후 재생의료 산업의 기준점이 되었습니다.
유럽에서는 2018년 TiGenix(현 Takeda Pharmaceuticals)의 Alofisel® (darvadstrocel) 이
EMA(유럽의약품청) 승인을 받아 크론병 복합 누공 치료제로 상업화에 성공했습니다.
그러나 2024년, 제조 및 공급상의 문제로 판매가 중단되면서,
세포치료제의 지속 가능한 생산체계와 품질관리(GMP) 인프라의 중요성이 다시 강조되었습니다.
즉, ‘효능’만큼이나 ‘공급 안정성’이 산업의 다음 과제가 된 셈입니다.

한편, ClinicalTrials.gov(2025) 기준으로 등록된 ADSC 관련 임상시험은 100건 이상으로,
그 적응증은 매우 다양합니다.
대표적인 예로,
- 퇴행성 관절염 환자를 대상으로 한 자가 ADSC 치료 연구,
- 당뇨성 상처(DFU) 및 만성 궤양 치료를 위한 조직 재생 임상,
- 척수 손상 및 혈관 재생(angiogenesis) 연구,
- 그리고 미세 지방 조직(MFAT, micro-fragmented adipose tissue)을 활용한 통증 완화 및 연골 재생 연구 등이 진행 중.
또한, 기관 단위 연구도 활발합니다.
미국의 Mayo Clinic은 ADSC 유래 엑소좀(extracellular vesicle, EV)의 혈관 회복 및 염증 조절 효과를 검증 중이며, 이는 세포 자체를 주입하지 않고 세포가 분비하는 생리활성 인자를 활용한다는 점에서
차세대 ‘비세포성(cell-free)’ 치료 전략으로 주목받고 있습니다.
요약하면,
ADSC 치료제의 규제·임상 환경은 ‘효능 입증 → 안전성·지속가능성 확보’로 진화 중이며,
한국·일본·미국·유럽이 서로 다른 제도적 틀 안에서 재생의료의 실질적 상용화 모델을 실험하고 있는 단계라고 할 수 있습니다.
3. 글로벌 기업과 산업 경쟁
지방 유래 줄기세포 산업은 미국과 한국을 중심으로 빠르게 형성되고 있으며, 유럽 쪽에서도 흥미로운 움직임이 관찰되고 있습니다. 미국은 “세포 뱅킹·플랫폼 기술 중심”, 한국은 “허가·상용화 중심”, 유럽은 “품질관리와 규제 정교화 중심”으로 전개되고 있습니다.
미국: 플랫폼 기술과 임상 확장 중심
BioRestorative Therapies Inc.
- 대표 프로그램 ThermoStem® 은 갈색지방 유래 줄기세포(BADSCs)를 이용해 비만, 당뇨 등 대사 질환을 타깃으로 하며,
- 2024년 유럽특허청(EPO)으로부터 관련 특허(3D 세포 배양 및 cGMP 공정 기술)에 대한 허가를 받았으며,
2040년까지 기술 보호가 보장되었습니다. - 이 회사는 세포 자체보다 세포 제조 플랫폼과 미세환경 제어 기술을 핵심 IP로 보호하고 있으며,
- 현재 BADSC 유래 엑소좀 기반 신약 후보군을 FDA와 협의 중이며, 비침습적 치료로의 확장을 꾀하고 있습니다.
Celltex Therapeutics
- 자가 지방 유래 줄기세포를 배양·보관하는 “Stem Cell Banking” 서비스를 운영하며,
이를 통해 환자 맞춤형 세포를 반복적으로 사용할 수 있는 인프라를 제공합니다. - 텍사스주 내 세포처리시설을 기반으로 자가 치료용 MSC/ADSC 임상 연구(예: NCT04448106)를 수행 중이며,
HCT/P 361 조항(미국 FDA의 최소 조작 규정) 내에서 환자 중심 모델을 지속 확장하고 있습니다.
InGeneron Inc.
- 20년 가까이 ADRC(Adipose-Derived Regenerative Cells) 기반 재생치료를 연구해 온 기업으로,
근골격계 손상(무릎·어깨 관절 통증) 대상 임상시험(NCT03752827)을 포함해
자가 세포 치료 장비 및 포터블 가공 시스템을 개발했습니다. - 이 회사의 강점은 현장(POC)에서 즉시 세포 처리·투여가 가능한 기기형 솔루션으로,
기존 세포 배양 기반 치료보다 절차를 단축시킨다는 점입니다.
한국: 조기 상용화와 세포은행 기반 인프라
Anterogen Co., Ltd.
- 2012년 식품의약품안전처(MFDS)로부터 Cupistem®(자가 지방유래 줄기세포 기반 크론병 누공 치료제)을 승인받으며,
세계 최초로 ADSC 세포치료제를 상용화한 기업입니다. - 2014년 건강보험 등재를 통해 임상·시장 양면에서 조기 진입에 성공했으며,
이후 세포은행(Cell Banking), GMP 고도화, 해외 기술수출을 추진하고 있습니다. - 최근에는 ADSC 유래 엑소좀 기반 제형과 동종 세포(allogeneic) 플랫폼을 병행 개발하며,
장기적으로는 면역·피부재생·자가면역질환으로 적응증을 확장하고 있습니다.
CHA Biotech / Medipost / SCM Lifescience 등도
지방줄기세포 기반의 화장품·피부재생 응용에서 출발해,
점차 항염·재생·노화 관련 질환으로 확장하며 ADSC 응용 생태계를 넓히고 있습니다.
유럽: 품질 관리와 규제 기반의 산업 구조
TiGenix / Takeda (Alofisel® / darvadstrocel)
- 2018년 EMA(유럽의약품청)로부터 크론병 누공 치료제로 Alofisel® 허가를 받으며,
세계 두 번째 ADSC 상용화 사례를 기록했습니다. - 그러나 2024년, 제조·공급 안정성 및 임상 재현성 부족을 이유로 유럽위원회(EC)가 판매 허가 철회를 결정했습니다.
- 이 사건은 세포치료제 산업의 지속 가능한 GMP 생산체계와 장기 품질관리의 중요성을 각국 규제기관에 각인시켰습니다.
Cytori Therapeutics (현 Lorem Vascular, EU Division)
- 지방조직 기반 세포치료 기술을 조기에 상용화한 기업으로,
유럽 내에서는 유방 재건 및 피부 손상 회복 분야에서 ADSC 기술을 적용했습니다. - 이후 Lorem Vascular와 기술제휴를 통해 의료기기 + 세포치료 통합 모델을 구축했습니다.
Cellaion (벨기에)
- 간섬유화·간부전 치료용 ADSC 유래 세포치료제를 개발 중이며,
EMA의 ATMP(첨단치료제) 트랙에 따라 2상 임상 준비를 진행하고 있습니다.
국가별 ADSC 산업 전략 비교표 (미국 · 한국 · 유럽)
※ 요약 비교: 규제 프레임·비즈니스 모델·임상 초점·제조/GMP·IP 전략·리스크/트렌드.
| 구분 | 미국 (USA) | 한국 (KOR) | 유럽 (EU) |
|---|---|---|---|
| 규제 프레임 | FDA HCT/P 체계: 361(최소조작) / 351(BLA) 구분 명확. 자가·최소조작은 상대적 유연성, 의약품형은 엄격 심사. | MFDS 중심의 신속·조건부 허가 트랙 운영. 조기 상용화 경험 축적(실사용 데이터 중시). | EMA ATMP(첨단치료제) 엄격 심사·GMP 요구. 허가 후에도 품질·공급 안정성 지속 평가. |
| 비즈니스 모델 | 세포 뱅킹·플랫폼 기술 중심(제조·공정·장비). 병원·클리닉 협업 통한 임상 확장. | 허가/보험 연계 상용화 + 세포은행 인프라. 국내 적응증 확대 및 해외 기술수출. | 품질관리·표준화 선도. 허가 이후 상업생산·공급망 안정화가 핵심 과제. |
| 대표 기업·사례 | BioRestorative (ThermoStem®), Celltex(자가 ADSC 뱅킹), InGeneron(ADRC 장비·임상), 연구기관: Mayo Clinic(ADSC 유래 EV 연구), Kessler Foundation(MFAT). | Anterogen(Cupistem® 세계 최초 ADSC 허가·보험 등재), 기타: CHA 계열·SCM 등 피부/재생 응용 확대. | TiGenix/Takeda (Alofisel® EMA 허가 → 2024 유통 철회), Cytori/Lorem Vascular(재건·피부 응용), Cellaion(간 질환 파이프라인). |
| 임상 초점 | 근골격계(관절·건·통증), 대사질환(비만·당뇨), 상처·혈관 재생, EV(엑소좀) 기반 연구. | 크론병 누공, 당뇨성 상처·만성 궤양, 피부/연부조직 재생, 관절·혈관 재생. | 염증성 장질환(누공), 재건성 수술 보조, 간·연부조직 재생(파일럿/2상 단계). |
| 제조·GMP 전략 | cGMP 공정 고도화, POC(현장) 처리 장비 개발, 분산형 제조 파일럿. | 중앙집중형 GMP + 세포은행 표준화, 공급망 안정화(저온유통·동결보존). | 엄격한 배치 릴리즈·QC 기준, 상업 생산 스케일업 및 재현성 요구 높음. |
| IP(지식재산) 전략 | 세포 자체보다 공정·배양환경·3D/미세환경·EV 제형 등 플랫폼 IP 중시. | 분리·동결보존·품질관리(Spec) 표준 특허 + 동종·엑소좀 전환 IP 확장. | 공정·품질관리·릴리즈 기준 특허 비중 높음(허가–제조 연계 IP). |
| 리스크·과제 | 361↔351 경계 규제 리스크, 장기안전성·비용, 다기관 재현성. | 글로벌 확장·해외 허가, 장기데이터·코스트, 동종 전환 시 면역/품질 이슈. | 공급망·스케일업·재현성, HTA/급여 진입 장벽, 철회 사례 후 보수적 평가. |
| 2025 키 트렌드 | EV·세포유래 제형 확대, 병원-기업 컨소시엄, 데이터 표준/리얼월드 근거(RWE). | 동종 플랫폼·엑소좀 상용화 준비, 해외 기술수출·공동임상, 보험 연계 확대. | 품질·공급 안정성 우선, ATMP 프레임 개선 논의, 국제 표준화 연계 프로젝트. |
산업 경향 요약
- 지식재산(IP) 중심의 경쟁 구도
대부분의 선도 기업은 “세포 자체”보다 제조 플랫폼·배양 환경·엑소좀 제형 기술을 핵심 IP로 보호하고 있습니다.
예를 들어 BioRestorative는 세포 배양의 3D 구조와 온도 최적화 메커니즘,
Anterogen은 ADSC의 분리·동결보존·품질관리 공정을 특허로 등록했습니다. - 비세포성(cell-free) 치료로의 전환
글로벌 트렌드는 점차 엑소좀·세포 배양액 등 ADSC 파생물질 기반 치료로 이동 중이며,
이는 비용 절감·보관 안정성·면역 안전성 측면에서 유리합니다. - 산업 구조의 이중화
미국·유럽은 R&D·플랫폼 중심,
한국·일본은 임상·상용화 중심으로 발전하고 있으며,
양 지역 간 기술·임상 데이터 교류가 활발히 이뤄지고 있습니다.
전망: 재생의학의 차세대 모듈
향후 지방 유래 줄기세포(ADSC) 산업의 성패는 임상 근거의 축적, 제조 표준화,
그리고 비용 구조의 혁신에 달려있다고 할 수 있습니다.
자가(autologous) ADSC는 면역 거부가 적고 윤리적 논란이 거의 없어, 초기 상용화 시장을 이끌 가능성이 높으며,
동종(allogeneic) ADSC 세포은행은 대량생산 체계가 확립되면 보험 적용과 치료 접근성을 동시에 앞당길 수 있을 것입니다.
또한 ADSC에서 분리한 엑소좀(Exosome, EV) 기술이 결합되며,
“세포 없이 세포의 효과를 내는 차세대 치료제”로 진화하는 추세입니다.
결국 ADSC 산업은 ‘버려진 세포를 치료 자원으로 바꾼 첫 성공 사례’로서,
재생의학이 환경적 순환과 의학적 혁신을 동시에 실현하는 모범 모델로 자리 잡아가고 있습니다.
참고자료
- Emergen Research (2025). Adipose-Derived Stem Cell Market Report.
- Grand View Research (2025). Stem Cell Therapy Market Report.
- European Medicines Agency. Alofisel (darvadstrocel) EPAR.
- MFDS (2012). Cupistem® Approval Notice.
- BioRestorative Therapies (2025). ThermoStem® Program.
- Celltex Therapeutics. Clinical Trials Overview.
- InGeneron. Adipose-Derived Regenerative Cells Programs.
- MSCs Trial (2023). Int J Mol Sci. PMCID: PMC10298392
관련 글
지방 조직에서 찾은 재생의학의 잠재력, 지방 줄기세포 (ADSCs)
지방과 근육, 세포의 경계를 넘다 (1)“버려진 지방에서 다시 태어나는 세포”다이어트나 성형수술 후에 버려지는 지방이,언젠가 재생의학의 핵심 자원이 될 것이라 상상한 사람이 있을까요?불
elitemara.com
엑소좀 치료제, '메시지'를 가공하는 첨단 기술과 과제
15년 차 연구자가 들려주는 알기 쉬운 줄기세포 이야기 목차개념에서 치료제로엑소좀, 어떻게 얻고 정제할까?엑소좀 분리 및 정제 기술의 종류와 원리고순도, 고수율의 엑소좀을 얻기 위한 기술
elitemara.com
엑소좀의 잠재력: 피부 재생부터 심혈관·신경질환 치료까지
15년 차 연구자가 들려주는 알기 쉬운 줄기세포 이야기 목차개념에서 임상으로, 엑소좀이 여는 새로운 치료 영피부 재생과 염증 치료: 줄기세포 엑소좀의 대표적 활용 사례엑소좀의 피부 미백,
elitemara.com
'Cell Talk | 줄기세포' 카테고리의 다른 글
| 탈모와 관절염, 성체 줄기세포가 여는 새로운 치료의 가능성 (9) | 2025.10.17 |
|---|---|
| 성체 줄기세포란 무엇인가: 우리 몸의 재생 엔진 (20) | 2025.10.13 |
| 근육이 퇴화하면 왜 지방으로 바뀔까? – 세포 운명 전환의 과학 (9) | 2025.10.08 |
| 지방 조직에서 찾은 재생의학의 잠재력, 지방 줄기세포 (ADSCs) (11) | 2025.10.05 |
| 줄기세포 리프로그래밍: 시험관(in vivo)에서 인체(in vivo)로 (9) | 2025.10.03 |

 English
English 日本語
日本語 Français
Français Español
Español 한국어
한국어